Christian Lanz,1,¤a Johan Mattsson,2 Umut Soydaner,1,¤b i Rudolf Brenneisen1,*
Faramarz Dehghani, redaktor naczelny
Źródło: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4718604/
Streszczenie
Inhalacja przez waporyzację jest obiecującym sposobem zastosowania marihuany w medycynie. Przeprowadzono walidację in vitro 5 komercyjnych waporyzatorów do konopiami indyjskimi typu THC i CBD. Do określenia odzysku całkowitego THC (THCtot) i całkowitego CBD (CBDtot) w parze użyto chromatografii gazowej/spektrometrii masowej.
Do kwantyfikacji kwaśnych kannabinoidów w pozostałościach oraz do obliczania skuteczności dekarboksylacji wykorzystano wysokosprawną chromatografię cieczową z detektorem fotodiodowym. Odzysk THCtot i CBDtot w oparach 4 elektrycznie sterowanych waporyzatorów wynosił odpowiednio 58,4 i 51,4%, 66,8 i 56,1%, 82,7 i 70,0% oraz 54,6 i 56,7% dla Volcano Medic (odpowiednik do ziól Volcano Hybrid)®, Plenty Vaporizer®, Arizer Solo® i DaVinci Vaporizer®. Skuteczność dekarboksylacji była doskonała dla THC (≥ 97,3%) i CBD (≥ 94,6%).
Zasilany gazem Vape-or-Smoke™ wykazał odzysk THCtot i CBDtot w parze odpowiednio 55,9 i 45,9%, a skuteczność dekarboksylacji ≥ 87,7 dla obu kanabinoidu.
Zaobserwowano jednak spalanie konopi indyjskich za pomocą tego urządzenia. Sterowane termicznie, elektrycznie sterowane waporyzatory skutecznie dekarboksylują nieaktywne kwaśne kannabinoidy i niezawodnie uwalniają odpowiadające im neutralne, aktywne kannabinoidy. W ten sposób oferują obiecujący tryb aplikacji dla bezpiecznego i skutecznego podawania leczniczych konopi indyjskich.
Wprowadzenie:
Konopie indyjskie mają bezkonkurencyjną historię ciągłej uprawy, która rozpoczęła się w starych Chinach w czasach neolitu 6000 lat temu. Była ona w tych czasach używana jako ważna roślina włóknista, a także jako lek [1]. Wnikliwa naukowa ocena medycznego wykorzystania marihuany sięga wstecz do pracy Sir Williama B. O’Shaughnessy’ego w latach 1838-1840 [2].
Od tego czasu konopie indyjskie były intensywnie badane. Na początku lat sześćdziesiątych XX wieku zidentyfikowano kannabidiol (CBD) i najbardziej psychoaktywny kannabinoid delta-9-tetrahydrokanabinol (THC) [3,4]. Do 2009 roku odkryto ponad 525 składników, w tym około 100 różnych kannabinoidów [5-7]. Pod koniec lat 80. i na początku lat 90. zidentyfikowano i sklonowano receptor kannabinoidowy 1 (CB1R) w tkance mózgowej oraz odkryto obwodowy receptor kannabinoidowy 2 (CB2R) [8-10].
W ostatnich latach uzyskuje się coraz więcej dowodów na to, że układ receptorów kannabinoidowych odgrywa kluczową rolę w regulacji wielu kluczowych funkcji utrzymania homeostazy [11]. Podejmowano wiele prób łagodzenia i leczenia objawów wielu różnych chorób poprzez aktywację lub hamowanie receptorów kannabinoidowych [8].
THC (dronabinol), który jest częściowym agonistą w stosunku do CB1R i w mniejszym stopniu również do CB2R, jest dostępny w wielu krajach w kilku wskazaniach [12]. Podaje się go doustnie w celu leczenia bólu, mdłości, spastyczności i utraty apetytu. Okazało się skuteczne u chorych na nowotwory, stwardnienie rozsiane, stwardnienie zanikowe boczne, ból przewlekły i inne choroby [7,12,13].
Jednak THC może powodować zależne od dawki psychotropowe skutki uboczne [12]. Jednocześnie obserwuje się rosnące zainteresowanie medycznym używaniem konopi indyjskich [13]. Oprócz THC inne kannabinoidy, a także nie- kannabinoidy, takie jak terpenoidy, najprawdopodobniej przyczyniają się do ogólnego działania farmakologicznego konopi indyjskich i modulują je [13-16].
Liczne ostatnie badania dowiodły przeciwzapalnych i neuroprotekcyjnych właściwości THC i CBD, innego głównego fitokannabinoidu [17]. Ponadto CBD wiadomo, że zmniejsza psychotropowe działanie THC [18]. Co więcej, THC i CBD działają synergistycznie [18,19]. Ważnym aspektem stosowania kannabinoidów w medycynie i oceny sposobów podawania są szczególne właściwości farmakokinetyczne tych wysoce lipofilnych związków.
W porównaniu z bardzo szybkim i dobrym wchłanianiem po podaniu pulmonalnym, wchłanianie po podaniu doustnym jest powolne, nieprzewidywalne i nieregularne. Odsetek 6-20% wykazuje bardzo niską ogólnoustrojową biodostępność doustną THC i innych kannabinoidów, co wynika z wrażliwości THC na kwaśny płyn żołądkowy i rozległego metabolizmu pierwszego przejścia w jelitach i wątrobie.
Ponadto stwierdzono, że biodostępność po podaniu doustnym jest bardzo zmienna, co wskazuje na niepewny początek działania [13,20,21]. Stwierdzono, że stężenie THC we krwi wynosi 25-30% tych, które wynikają z palenia tej samej dawki [21].
Kolejny aspekt należy wziąć pod uwagę w odniesieniu do stosowania leczniczych konopi indyjskich. THC i CBD są obecne w roślinie odpowiednio jako kwas THC A (THCA-A) i kwas CBD (CBDA), które są nieaktywne farmakologicznie i dlatego muszą być najpierw przekształcone w aktywne związki neutralne.
Dekarboksylacja jest zależna od temperatury i występuje w wysokich temperaturach > 180°C, co jest powodem tradycyjnego palenia konopi indyjskich w celach rekreacyjnych [22]. Palenie konopi indyjskich jest jednak potencjalnie szkodliwe, a tym samym niedopuszczalne w celach terapeutycznych.
W związku z tym, a także biorąc pod uwagę złą farmakokinetykę doustną kannabinoidów, potrzebne są alternatywne techniki podawania [13,15,21], takie jak inhalacja przez waporyzacja konopi indyjskich lub kannabinoidów. Ten skuteczny i mniej szkodliwy tryb podawania pulmonów jest również interesujący dla pacjentów, którzy nie są w stanie połknąć.
W przypadku pacjentów cierpiących na ciężkie choroby dróg oddechowych należy dokładnie ocenić stosowanie waporyzatorów. W takich przypadkach alternatywą mogą być konopie indyjskie lub preparaty kannabinoidowe (aerozole i tabletki dwujęzyczne).
Waporyzatory dekarboksylanowe kwasy kannabinoidowe w temperaturze około 200°C uwalniają neutralne, lotne kannabinoidy, które dostają się do krążenia ogólnoustrojowego poprzez wchłanianie oparów z płuc [22]. Niepirolityczne waporyzacja zapobiega tworzeniu się niebezpiecznych produktów spalania, takich jak smoła, wielopierścieniowe węglowodory aromatyczne (WWA), tlenek węgla i inne substancje rakotwórcze (np. benzen) [22-25].
Gieringer i współpracownicy wykazali zalety waporyzacji konopi indyjskich w porównaniu z paleniem tytoniu i wykazali, że powstawanie produktów spalania jest prawie całkowicie tłumione. Jednak uwalnianie konopi indyjskich do pary zależy od zastosowanego urządzenia [23-25].
Trzydzieści sześć do 61% THC obecnego w konopiach indyjskich stwierdzono w parze przy użyciu waporyzatora Volcano Medic® w temperaturze 226°C. W oparach znaleziono tylko 3 nieanabinoidy. Natomiast w dymie spalonych konopi indyjskich zidentyfikowano około 150 substancji chemicznych, w tym 5 WWA, znanych jako silne substancje rakotwórcze [25].
Fischedick i współpracownicy dokonali kompleksowego porównania dymu i oparów konopi indyjskich przy użyciu Volcano Medic® [26]. Wykazali oni brak produktów pirolizy w parze w temperaturze 200°C i większą skuteczność ulatniania się z waporyzatorem niż z papierosem. Kilka grup przeprowadziło kompleksową ocenę preparatu Volcano Medic®.
Hazekamp i współpracownicy określili optymalne parametry parowania konopi indyjskich [22]. Podawanie THC do pary w zależności od temperatury zostało zademonstrowane przez Pomahacovą i współpracowników, którzy stwierdzili najwyższą wydajność THC oraz optymalny stosunek konopi indyjskich do szkodliwych produktów ubocznych w temperaturze 230°C [27].
Oceny farmakokinetycznej i farmakodynamicznej tego samego waporyzatora dokonali Abrams i współpracownicy [28]. Wykazali oni porównywalne wyniki farmakokinetyczne i farmakodynamiczne pomiędzy paleniem tytoniu a parowaniem konopi, podczas gdy produkcja tlenku węgla, jako wskaźnika spalania, została całkowicie wytłumiona za pomocą waporyzatora.
Skuteczność płucnego wchłaniania THC we wdychanym powietrzu została również wykazana przez Naefa i jego współpracowników, porównując podane dożylnie THC do płucnego wchłaniania THC uwalnianego jako płynny aerozol z nebulizatora ciśnieniowego [29]. Dalsze dane farmakodynamiczne potwierdzające skuteczność wchłaniania do płuc są dostępne z czystego THC waporyzowanego za pomocą Volcano Medic® [30].
Ponadto, dowody na kliniczną przydatność, akceptację i korzyści wynikające z waporyzacji THC zamiast palenia tytoniu zostały przedstawione w 2 badaniach badających objawy płucne. W jednym z nich stwierdzono na podstawie kwestionariusza znaczne zmniejszenie problemów z oddychaniem, takich jak kaszel, flegma i ucisk w klatce piersiowej u osób używających konopi indyjskich, które waporyzowały zmielony susz grinder CBD/THC [31].
W drugim badaniu monitorowano funkcję płuc za pomocą spirometrii u osób palących konopie indyjskie przed i po użyciu waporyzatora [32]. Wykazało ono poprawę i normalizację funkcji płuc w ciągu jednego miesiąca.
Zgodnie z naszą wiedzą Volcano Medic® jest obecnie jedynym waporyzatorem, który został gruntownie zatwierdzony do waporyzacji marihuany zgodnie z normami naukowymi i jak dotąd nie opublikowano żadnych porównań z innymi waporyzatora. Dlatego też celem niniejszego badania było zbadanie in vitro działania 3 kieszonkowych i 1 ręcznych waporyzatorów dostępnych na rynku szwajcarskim w porównaniu z waporyzatorem stołowym Volcano Medic® jako złotym standardem.
Materiały i metody
Chemikalia
Z Lipomed (Arlesheim, Szwajcaria) otrzymano następujące kalibrowane normy deuterowane i niedeuterowane: THC (1 mg/mL w etanolu), cannabinol (CBN; 1 mg/mL w metanolu), THCA-A (1 mg/mL w izopropanolu), THC-D3 (0,1 mg/mL w etanolu) i CBN-D3 (0,1 mg/mL w metanolu). CBD i CBD-D3 zostały zakupione od THC Pharm (Frankfurt a.M., Niemcy) odpowiednio jako proszek i kalibrowany wzorzec (1 mg/mL w metanolu). Cannabichromen (CBC) został zakupiony od Toronto Research Chemicals (Toronto, Ontario, Kanada).
CBDA został dostarczony przez ReseaChem (Burgdorf, Szwajcaria), a syntetyczny THC (dronabinol) przez Hänseler (Herisau, Szwajcaria). Wszystkie wzorce zostały rozcieńczone w MeOH w celu uzyskania kalibratora i próbek kontrolnych o pożądanych stężeniach. Samice szczytów kwiatowych konopi THC dostarczono z Bedrocan BV (Veendam, Holandia), konopie CBD dostarczono od lokalnego producenta.
Wszystkie chemikalia i rozpuszczalniki miały odpowiednio stopień analityczny i HPLC i zostały uzyskane od Sigma-Aldrich Chemie (Buchs, Szwajcaria) lub Merck (Darmstadt, Niemcy). Wkłady z polipropylenu (Chromabond, 15 mL) do ekstrakcji fazy stałej (SPE) dostarczyła firma Macherey-Nagel (Oensingen, Szwajcaria), a LiChroprep RP-18 (40-63 μm) użyty jako sorbent pochodził od firmy Merck.
Przygotowanie i kwantyfikacja materiałów do badań (konopie indyjskie, wzorce kanabinoidowe)
Suszone konopie były rozdrabniane i homogenizowane ostrożnie w moździerzu i przechowywane w temperaturze 4°C.
Pięć podwielokrotności 100 mg każdego rodzaju konopi ważyło się do szklanych fiolek o pojemności 10 ml z nakrętkami pokrytymi teflonem (Infochroma, Zug, Szwajcaria) i połączono z 1,0 mL metanolu zawierającego 10% (v/v) chloroformu (MeOH-CHCl3 9:1). Fiolki były szczelnie zamknięte, a próbki były ekstrahowane przez 15 min w kąpieli ultradźwiękowej w temperaturze pokojowej.
Po przefiltrowaniu za pomocą pipety Pasteura z wełną szklaną ekstrakt został 10 razy rozcieńczony MeOH. Dziesięć μl tego rozcieńczenia połączono z 25 μl roztworu wzorca wewnętrznego (IS; THC-D3, CBD-D3 i CBN-D3; po 40 μg/ml każdy w MeOH) i 65 μl MeOH i poddano analizie metodą chromatografii gazowej/spektrometrii mas (GC/MS). Do analizy wysokosprawnej chromatografii cieczowej (HPLC) wykorzystano 100-krotne metanolowe rozcieńczenie ekstraktu.
Do walidacji waporyzatorów z wzorcami kannabinoidowymi przygotowano roztwór metanolowy zawierający THC i CBD po 40 mg/ml każdy. Żywiczny THC podgrzewano ostrożnie w temperaturze 60°C za pomocą dmuchawy z gorącym powietrzem i ważono bezpośrednio do 5-mililitrowej kolby pomiarowej, połączono z CBD i rozpuszczono w MeOH-CHCl3 9:1.
Urządzenia: waporyzatory i ogólne ustawienia eksperymentalne
Zatwierdzono cztery elektryczne i jeden butanowy waporyzator. Waporyzator stacjonarny stołowy Volcano Medic® (Volcano Hybrid do waporyzacji ziół) i Plenty Vaporizer® zostały pozyskane od firmy Storz & Bickel (Tuttlingen, Niemcy). Przenośne waporyzatory Arizer Solo® zostały zakupione od Arizer Tech (Waterloo, Kanada), DaVinci Vaporizer® od Organicix (Las Vegas, USA) oraz Vape-or-Smoke™ od Elemental Technologies (Seattle, USA).
Waporyzatory były eksploatowane zgodnie z instrukcjami producenta. Dla wszystkich waporyzatorów z napędem elektrycznym temperatura została ustawiona na 210°C. Temperatura Vape-or-Smoke™ nie mogła być kontrolowana ani monitorowana. Aspirację oparów przez kolumnę SPE wykonywano przy ciśnieniu 420 mbar przez 3 minuty, a następnie 1 minutę przy ciśnieniu 100 mbar dla urządzeń kieszonkowych. 420 mbar zastosowano w celu całkowitej ewakuacji balonu Volcano Medic®.
Marihuana typu THC z 4,61% całkowitym THC (THCtot: THC + THC tworzone przez termiczną dekarboksylację z kwasów THC podczas analizy GC/MS) oraz konopi typu CBD z 2,60% CBD (CBDtot: CBD + CBD tworzone w wyniku termicznej dekarboksylacji z kwasów suszu CBD podczas analizy GC/MS) oraz 0,53% THCtot. Eksperymenty przeprowadzono dla każdego urządzenia z 50 mg materiału roślinnego w triplatach dla obu odmian konopi. Taką samą liczbę doświadczeń przeprowadzono z 2 mg wzorców THC i CBD (50 μL THC i CBD, po 40 mg/ml każdy w MeOH-CHCl3 9:1).
Dla każdego doświadczenia zebrano cztery różne frakcje: (i) para, (ii) wszystkie części urządzeń, które miały kontakt z próbką lub parą, takie jak komora na próbki i ustnik, (iii) pozostałość po waporyzacji oraz (iv) rurka polipropylenowa łącząca ustnik lub balon w przypadku Volcano Medic® z pompą próżniową. Para została uwięziona na kolumnie SPE (wkład Chromabonda o pojemności 15 ml wypełniony ręcznie 1 g LiChroprep RP-18) za pomocą pompy próżniowej Büchi B-172, wyposażonej w sterownik Büchi B-168 do zastosowań próżniowych/destylacyjnych (Büchi Labortechnik, Flawil, Szwajcaria).
Eluaty SPE były następnie kwantyfikowane przez GC/MS dla THC, CBD i CBN. W celu dalszego wyjaśnienia skuteczności procesu dekarboksylacji i waporyzacji, pozostałości w komorach próbek i elementach łączących były po płukaniu MeOH-CHCl3 9:1 analizowane również metodą GC/MS i dodatkowo HPLC odpowiednio dla kanabinoidów obojętnych i kwaśnych.
Procedury waporyzacji
Po nałożeniu 50 mg konopi indyjskich na komorę próbkowania Volcano Medic® jako cienkiej warstwy pokrywającej całą siatkę i połączeniu balonu z zaworem z komorą próbkowania, dokonano waporyzacji zgodnie z instrukcjami producenta. Urządzenie zostało wstępnie podgrzane w temperaturze 210°C. Balonik po całkowitym wypełnieniu połączono z ustnikiem i za pomocą rurki polipropylenowej o długości 8 cm połączono z kolumną SPE szczelnie połączoną z systemem próżniowym.
Sterownik próżniowy pompy został ustawiony na 420 mbar, a cała objętość balonu została zassana przez kolumnę SPE. Następnie usunięto kolumnę SPE i wymyto około 4 mL MeOH-CHCl3 9:1 za pomocą urządzenia Adsorbex SPE (Merck, Darmstadt, Niemcy). Następnie eluat został zwaporyzowany do sucha w temperaturze 40°C pod delikatnym strumieniem azotu (waporyzator TurboVap® LV, Zymark, Oftringen, Szwajcaria).
Pozostałość odtworzono w 0,5 mL MeOH-CHCl3 9:1, poddano wirowaniu i rozcieńczono w stosunku 1:10 z MeOH. Do 10 μL tego rozcieńczenia dodano 25 μL IS i 65 μL MeOH. Próbka ta została następnie poddana analizie GC/MS w celu oznaczenia zawartości THC, CBD i CBN.
Ustnik i komorę na próbkę przepłukano ostrożnie około 5 mL MeOH-CHCl3 9:1, a następnie oddzielnie przewód łączący ustnik z kolumną SPE. Próbki zostały waporyzowane pod strumieniem azotu w temperaturze 40°C i odtworzone w 0,5 mL MeOH-CHCl3 9:1, jak opisano powyżej.
Z każdej próbki przygotowano 10-krotne rozcieńczenie, dodając 25 μL IS i 65 μL MeOH do 10 μL odtworzonej próbki. Pozostały materiał roślinny z komory próbnej został ekstrahowany za pomocą 0,5 mL MeOH-CHCl3 9:1, jak opisano powyżej, w celu oznaczenia ilości materiału badawczego konopi indyjskich. 25 μL IS i 65 μL MeOH dodano do 10 μL przefiltrowanego ekstraktu i poddano analizie metodą GC/MS.
Ten sam ekstrakt został rozcieńczony w proporcji 1:10 MeOH i poddany analizie HPLC. Do walidacji urządzenia z wzorcami kanabinoidowymi ostrożnie zrzucono 50 μl roztworu wzorcowego (THC i CBD, po 40 mg/ml każdy w MeOH-CHCl3 9:1) na metalową podkładkę z płynami, specjalnie zaprojektowaną przez producenta do waporyzacji cieczy.
Z komory próbki usunięto 2 ekrany i zamontowano płynną podkładkę. Komorę na próbkę podłączono do wstępnie ogrzanego Volcano Medic® o temperaturze ustawionej na 100°C i włączono wentylator na 45 s w celu wyeliminowania rozpuszczalników. Następnie usunięto komorę na próbkę z urządzenia i podłączono ją do balonika, podnosząc jednocześnie temperaturę do 210°C.
Po osiągnięciu temperatury 210°C komorę na próbkę wraz z balonem podłączono ponownie do urządzenia, natychmiast włączono wentylator i zastosowano tę samą procedurę, którą opisano dla konopi. Następnie pad w płynie pokryto MeOH-CHCl3 9:1 i sonikowano przez 15 min w celu ekstrakcji pozostałych kanabinoidów. Delikatnym strumieniem azotu odparowano rozpuszczalnik w temperaturze 40°C, próbkę odtworzono w 0,5 mL MeOH-CHCl3 9:1 i poddano analizie GC/MS oraz HPLC po 10-krotnym rozcieńczeniu, jak opisano dla pozostałych frakcji.
Urządzenie Plenty Vaporizer® pracowało w najwyższej ustawionej temperaturze (poziom 7) odpowiadającej 210°C. W celu walidacji za pomocą konopi, 50 mg materiału roślinnego zostało naniesione na komorę próbkowania i utrwalone za pomocą płynnej podkładki.
W celu walidacji za pomocą wzorców konopi indyjskich, 50 μl roztworu wzorcowego zostało naniesione na bibułę filtracyjną (Schleicher & Schuell, Dassel, Niemcy) przyciętą do wielkości komory próbki. Rozpuszczalnik został odparowany pod delikatnym strumieniem azotu w temperaturze pokojowej, a bibułę filtracyjną umieszczono w komorze na próbki.
Wyjęto ustnik umieszczony na końcu rurki chłodzącej urządzenia i podłączono rurkę bezpośrednio do kolumny SPE. Komorę z próbkami zamontowano na waporyzatorze. Po przekroczeniu temperatury 205°C włączono pompę próżniową i wykonywano odsysanie przez 3 minuty przy ciągłym przepływie z regulatorem próżni ustawionym na 420 mbar, a następnie 1 minutę przy 100 mbar.
Pobieranie i przygotowanie próbek różnych frakcji odbywało się w sposób opisany dla Volcano Medic®. W szczególności należało bardzo dokładnie przepłukać płytki rurki chłodzącej. Bibułę filtracyjną wykorzystywaną do waporyzacji wzorców sondowano przez 15 minut z odpowiednią objętością MeOH-CHCl3 9:1. Rozpuszczalnik odparowano pod delikatnym strumieniem azotu w temperaturze 40°C, próbkę odtworzono w 0,5 mL MeOH-CHCl3 9:1 i poddano analizie GC/MS i HPLC.
W celu walidacji Arizer Solo®, temperatura została ustawiona na najwyższym poziomie (7), który zgodnie z instrukcją producenta odpowiada 210°C. Prosta szklana rurka została połączona z 8-centymetrową rurką polipropylenową z kolumną SPE.
W rurce umieszczono odpowiedni kawałek wełny szklanej, aby przykryć stosunkowo duże otwory w przegrodzie szklanej, oddzielając górną część rurki od komory próbki, aby uniknąć zasysania materiału roślinnego przez próżnię. W celu walidacji za pomocą wzorców kanabinoidowych ostrożnie nałożono 50 μL (2 mg) roztworu metanolowego na bawełniany osad (10 ± 2 mg).
Rozpuszczalnik znajdujący się na osadzie został wyeliminowany w temperaturze pokojowej pod wpływem delikatnego strumienia azotu. Włączono podgrzewacz i natychmiast po osiągnięciu temperatury uruchomiono szklaną rurkę, napełnioną wstępnie badanymi materiałami, zamontowaną na urządzeniu oraz pompę próżniową. Aspirację pary przez kolumnę SPE wykonywano, jak opisano w przypadku urządzenia Plenty Vaporizer®, przez 3 minuty przy ciśnieniu 420 mbar, a następnie 1 minutę przy ciśnieniu 100 mbar.
Frakcje próbek uzyskano i przetworzono w sposób opisany szczegółowo dla Volcano Medic®. Granulat bawełniany użyty do waporyzowania wzorców ekstrahowano odpowiednią objętością MeOH-CHCl3 9:1 metodą sonikacji przez 15 min, a następnie odparowywano rozpuszczalnik pod azotem w temperaturze 40°C, odtwarzano pozostałości w 0,5 mL MeOH-CHCl3 9:1 i analizowano metodą GC/MS i HPLC.
Urządzenie DaVinci Vaporizer® pracowało w temperaturze 210°C. Ustnik został połączony z 8-centymetrową rurką polipropylenową z kolumną SPE. Komorę na próbki załadowano 50 mg konopi indyjskich.
W celu walidacji za pomocą wzorców kanabinoidowych, 50 μL (2 mg) roztworu wzorcowego zostało przeniesione do puszki z olejem dostarczonej wraz z urządzeniem. Puszka z olejem została włożona do komory na próbki. Aby usunąć rozpuszczalnik, uruchomiono podgrzewacz przy temperaturze ustawionej na 100°C, a komorę na próbki pozostawiono otwartą na 1 minutę po osiągnięciu temperatury.
W celu waporyzacji konopi indyjskich lub kanabinoidów zamknięto komorę na próbki obciążoną badanymi materiałami i włączono grzałkę. Pompa próżniowa została uruchomiona natychmiast po osiągnięciu temperatury 210°C, a pobieranie oparów zostało przeprowadzone w sposób opisany powyżej dla urządzenia Plenty Vaporizer®.
Urządzenie zostało zdemontowane, a frakcje próbek pobrano, poddano obróbce i analizie w sposób opisany szczegółowo dla Volcano Medic®.
Do walidacji Vape-or-Smoke™ zastosowano 50 mg konopi indyjskich lub 2 mg (50 μL) wzorców kannabinoidowych na komorze próbki. Tę samą procedurę z użyciem granulek bawełnianych zastosowano do waporyzacji wzorców kannabinoidowych, jak opisano w przypadku Arizer Solo®.
Ustnik waporyzatora został połączony z 8-centymetrową rurką polipropylenową do kolumny SPE, a kolumna SPE połączona z pompą próżniową. Pompa próżniowa pracowała przy ciągłym przepływie z regulatorem próżni ustawionym na 420 mbar przez 3 minuty, podczas gdy płomień gazu butanowego waporyzatora był zapalany średnio po 6 cykli na minutę, po 3 s każdy.
Na koniec regulator podciśnienia został ustawiony na 100 mbar, a waporyzacja trwało jeszcze 1 minutę przy tej samej procedurze pośredniej. Frakcje próbek były pobierane, przetwarzane i analizowane w sposób opisany szczegółowo dla Volcano Medic®. Granulki bawełniane używane do waporyzacji wzorców kannabinoidowych zostały wyekstrahowane zgodnie z opisem dla Arizer Solo®.
Badanie GC/MS
Zastosowano chromatograf gazowy HP 5890 II wyposażony w próbnik HP 6890 oraz detektor masowy (MSD) HP 5972 (Agilent Technologies, Palo Alto, CA, USA). Podwielokrotną porcję o objętości 1μL wstrzyknięto bez podziału na kolumnę kapilarną Agilent DB-1MS (25 m x 0,25 mm i.d., 0,25-μ m błona) po 0,5 min. wyrównania kolumny i poddano programowi temperaturowemu: 100°C przez 1 min, w temp. 25°C/min do 175°C, w temp. 5°C/min do 200°C i wreszcie w temp. 10°C/min do 300°C (całkowity czas pracy 18,0 min).
Temperatura wtryskiwacza, linii przesyłowej i źródła jonów wynosiła odpowiednio 250, 280 i 166°C. Jako gaz nośny zastosowano hel przy stałym przepływie 1,0 mL/min (67 kPa w 100°C). Układ MS pracował w standardowym uderzeniu elektronu (70 eV, 35 μA prądu emisji) w połączeniu z wybranym trybem monitorowania jonów (SIM).
Układ MSD pracował w czasie od 3,5 do 18,0 min, rejestrując 3 grupy jonów odpowiadające CBD (3,5-14,9 min), THC (14,9-15,6 min) i CBN (15,6-18,0 min). Kwalifikator (czas przebywania 60 ms) i jony kwantyfikowalne (jon docelowy podkreślony, czas przebywania 100 ms) dla CBD i CBD-D3 (IS) wynosiły odpowiednio m/z 246 i 231 oraz 249 i 234.
W przypadku THC i THC-D3 (IS) wartości jonów kwalifikatora (czas przebywania 40 ms) i jonów ilościowych (czas przebywania 80 ms) wynosiły odpowiednio m/z 314, 299 i 231 oraz 317, 302 i 234. W przypadku CBN i CBN-D3 (IS) kwalifikator (czas przebywania 40 ms) i jony kwantyfikowalne (czas przebywania 80 ms) wynosiły odpowiednio m/z 310, 238 i 295 oraz 313, 241 i 298.
Jony dla CBD i THC były rejestrowane z wysoką rozdzielczością, natomiast jony CBN były monitorowane z niską rozdzielczością. Do pracy z urządzeniem, rejestracji i analizy danych wykorzystano rozszerzone oprogramowanie ChemStation G1701BA w wersji B.00.00 firmy Agilent. Ilościową analizę oparto na kalibracji wewnętrznej i nieważonej analizie regresji liniowej (model najmniejszych kwadratów), obliczając stosunek powierzchni pików analitów niedeuterowanych do deuterowanych (IS).
Kalibratory i próbki kontroli jakości zawierające THC, CBD i CBN zostały przygotowane z handlowych roztworów wzorcowych poprzez rozcieńczenie MeOH i odpowiednie zdeuterowane wzorce dodane jako IS przy 10 μg/mL. Trzy zestawy kalibracyjne zostały przygotowane i zmierzone w 3 różnych dniach, obejmując 1-250 μg/mL dla CBD i CBN oraz 2-250 μg/mL dla THC. Zastosowano dziewięć stężeń kalibratorów dla CBD i CBN (1, 2, 5, 10, 20, 50, 100, 150 i 250 μg/mL) oraz 8 (2, 5, 10, 20, 50, 100, 150 i 250 μg/mL) dla THC.
Połączoną krzywą wzorcową obliczono dla każdego związku na podstawie średnich stosunków powierzchni piku trzech kalibratorów dla każdego stężenia. Cztery poziomy próbek kontrolnych (3, 15, 40 i 130 μg/mL) wykorzystano do walidacji próby i monitorowania stabilności metody podczas analizy próbki.
Walidację metody przeprowadzono poprzez określenie zakresu liniowości, dokładności, precyzji i dolnej granicy oznaczalności (LLOQ; S/N = 10). Dane dotyczące precyzji i dokładności w ciągu dnia (n = 5) oraz między dniami (n = 5) uzyskano dla próbek kontrolnych przy zastosowaniu 4 poziomów stężeń (3, 15, 40 i 130 μg/mL). Przypisanie pików opierało się na czasach retencji (CBD 14,5, THC 15,3, CBN 15,9 min) i widmach masowych.
Badanie HPLC
System HPLC serii Agilent 1100 (Agilent Technologies, Palo Alto, CA, USA) składający się z odgazowywacza, pompy kapilarnej, detektora fotodiodowego (PDA), termostatu kolumnowego oraz kontrolowanego temperaturowo mikro-automatycznego próbnika cieczy został użyty do ilościowego oznaczania THCA-A, CBDA, THC, CBD i CBN. Dziesięćμl podwielokrotności wstrzykiwano do kolumny o wymiarach 125 x 4 mm i.d. Spherisorb ODS I (wielkość cząstek 3-μm) (Macherey-Nagel, Oensingen, Szwajcaria) wyposażonej w prekolumnę nukleozylową C8 (wielkość cząstek 3 μm; Macherey-Nagel).
Separację przeprowadzono w temperaturze 40°C i detekcję przy 230 nm z szerokością pasma ustawioną na 4 nm. Dla przypisania pików rejestrowano widma PDA od 190 do 400 nm. Zastosowano dwuskładnikowy układ rozpuszczalników składający się z MeOH (A) i 0,1% kwasu octowego (B). Przed analizą każdej partii, kolumna była przez 30 minut równoważona 50% (A).
Przepływ zwiększano co 5 min z przyrostem 0,15 mL/min z 0,1 do 0,7 mL/min, uzyskując ciśnienie 180 bar. Liniowy gradient był następujący: 50% (A) do 90% (A) w 20 min, utrzymywany w 90% (A) przez 1,5 min i zmniejszany do 50% (A) w 22 min. Oprogramowanie HP ChemStation dla LC 3D Rev. A.09.03 zostało użyte do obsługi urządzenia, rejestracji i oceny danych. Kwantyfikację oparto na zewnętrznej kalibracji z wykorzystaniem analizy regresji liniowej (model najmniejszych kwadratów).
Połączone kalibratory i próbki kontroli jakości zawierające wszystkie 5 analitów przygotowano w MeOH poprzez rozcieńczenie handlowych roztworów wzorcowych do stężeń końcowych. Trzy zestawy kalibratorów zostały przygotowane i zmierzone w 3 różnych dniach w celu obliczenia średnich krzywych kalibracyjnych dla każdego związku ze średnich powierzchni pików na każdym poziomie stężenia.
Zakresy kalibracji wynosiły 1-250 (8 kalibratorów: 1, 2, 5, 10, 25, 50, 100 i 250 μg/ml), 0,4-250 (9 kalibratorów), 0,4-50 (7 kalibratorów), 1-500 (9 kalibratorów) i 0,4-250 μg/ml (9 kalibratorów) odpowiednio dla CBD, CBDA, CBN, THC i THCA-A.
Do walidacji testu i monitorowania stabilności systemu podczas analizy próbek zastosowano 4 próbki kontroli jakości (2,5, 20, 40 i 80 μg/mL) dla CBD, CBDA i THCA-A, 3 niższe stężenia dla CBN i dodatkowe (400 μg/mL) dla THC. Do charakterystyki testu HPLC użyto tych samych parametrów wydajnościowych, które opisano dla metody GC/MS.
Wyniki i dyskusja
Walidacja testów
Metody GC/MS i HPLC do oznaczania kannabinoidów zostały zwalidowane zgodnie z wytycznymi FDA dotyczącymi walidacji [33]. Badania wykazały, że są solidne, selektywne, powtarzalne, dokładne i czułe. Dane dotyczące precyzji i dokładności (błędu systematycznego) w ciągu dnia i między dniami zostały podsumowane w tabelach danych pomocniczych S1 i S2.
Ilość badanych materiałów (konopie indyjskie i normy kanabinoidalne)
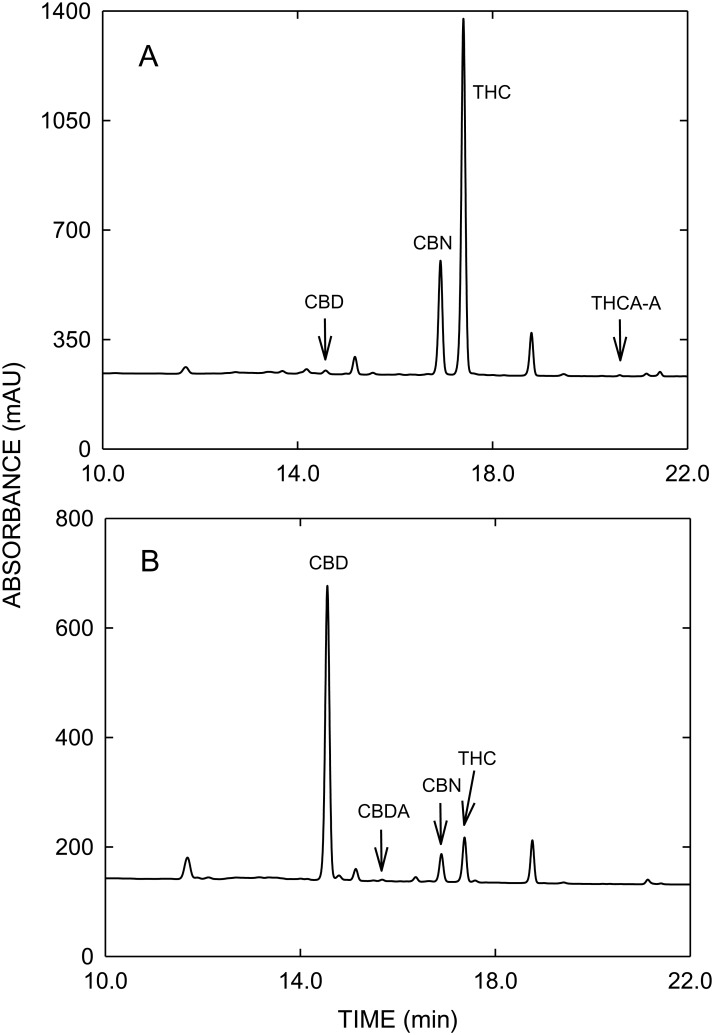
Zawartość kanabinoidów w konopiach indyjskich typu THC i CBD wykorzystywanych do walidacji waporyzatorów, określona za pomocą GC/MS i HPLC, została podsumowana w tabeli informacji uzupełniających S3, natomiast typowe profile GC/MS i HPLC przedstawiono odpowiednio na rysunkach 11 i 2,2.
Analiza HPLC wykazała, że 90,4% THCtot było obecne jako THCA-A w marihuanie typu THC, podczas gdy w marihuanie typu CBD CBDA stanowiło 85,8% CBDtot. Stężenia THCtot i CBDtot oznaczone za pomocą HPLC były o około 20% wyższe w porównaniu z tymi otrzymanymi za pomocą GC/MS, co można wyjaśnić niepełną dekarboksylacją termiczną kwaśnych kannabinoidów we wstrzyknięciu GC opisaną przez Dussy’ego i współpracowników [34]. Zawartość CBN jako produktu degradacji THC była niska w typie THC i nie stwierdzono obecności CBN w konopiach typu CBD.
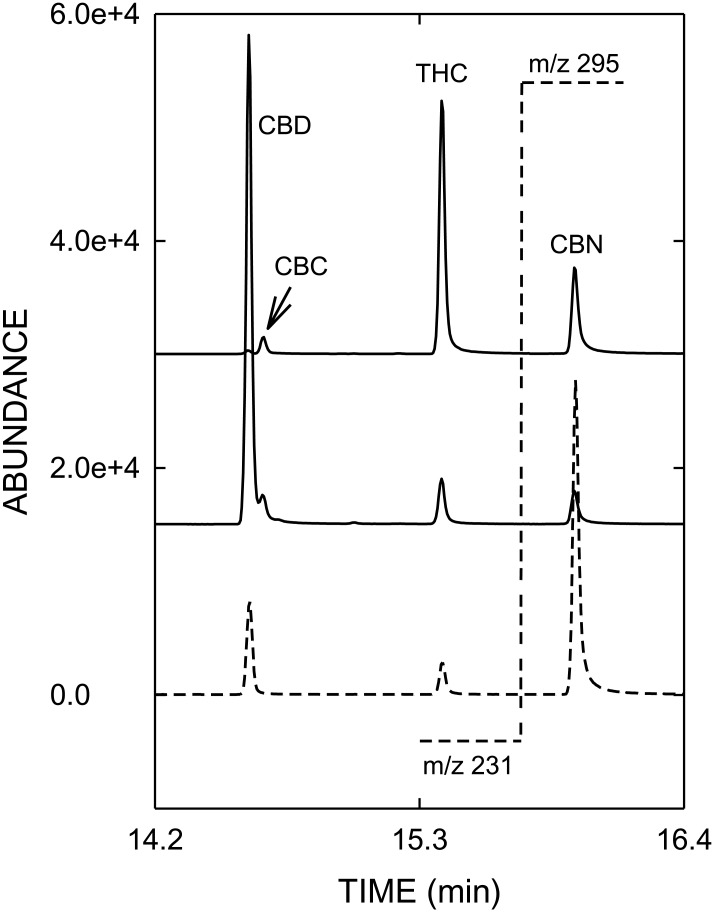
Rysunek 1
Profile GC/MS-SIM (od dołu do góry) analitycznej mieszanki wzorcowej, konopi indyjskich typu CBD i konopi indyjskich typu THC.
Przedstawione wartości śladowe jonów docelowych to m/z 231 dla CBD i THC (lewa strona linii przerywanej po 15,6 min), m/z 295 dla CBN (prawa strona linii przerywanej). Skróty: CBC = cannabichromene, CBD = cannabidiol, CBN = cannabinol, THC = delta-9-tetrahydrocannabinol.
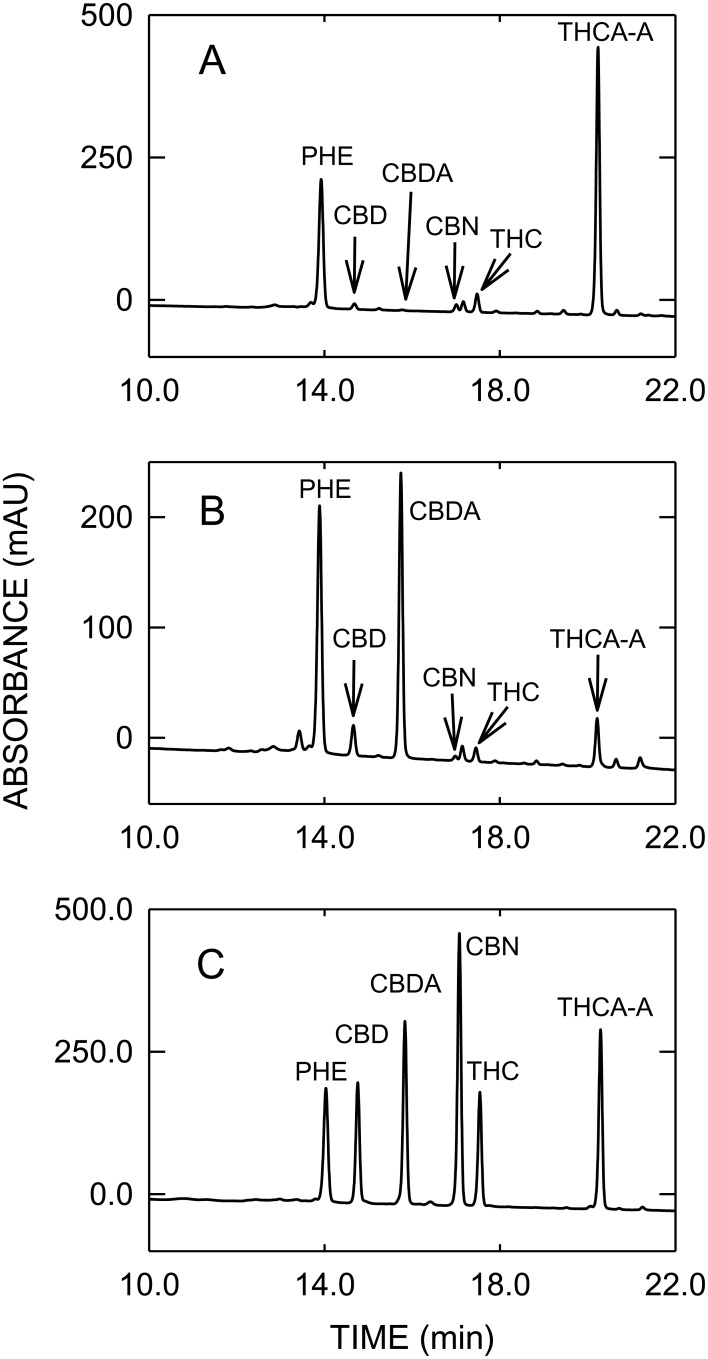
Rysunek 2
Profile HPLC konopi indyjskich typu THC (A), konopi indyjskich typu CBD (B) oraz wzorcowej mieszanki analitycznej (C).
Skróty: PHE = fenantren, CBD = kannabidiol, CBDA = kwas kannabidiolowy, CBN = kannabinol, THC = delta-9-tetrahydrokanabinol, THCA-A = kwas delta-9-tetrahydrokanabinolowy A.
Walidacja waporyzatorów in vitro
Dane dotyczące odzysku, tj. stężenia kanabinoidów mierzone we frakcjach próbek (para, pozostałość, części waporyzatora) pięciu badanych waporyzatorów są podsumowane w tabeli 1 i rys. 3. Dane dotyczące rurki łączącej nie są ujęte w rycinie 3, ponieważ wykryto jedynie śladowe ilości (< 1%) lub nie wykryto żadnych kanabinoidów. Na rycinie 4 przedstawiono typowe profile GC/MS pary (wykresy górne) i pozostałości (wykresy dolne) otrzymane z konopi typu THC (A) i CBD (B).
Odsetek całkowitej ilości kanabinoidów w różnych frakcjach zebranych z 5 waporyzatorów.
| Waporyzator | Fraction | Cannabis [Mean ± SD (RSD)1] | Standards [Mean ± SD (RSD)1] | |||
|---|---|---|---|---|---|---|
| THC-type | CBD-type | |||||
| THC (%) | THC (%) | CBD (%) | THC (%) | CBD (%) | ||
| Volcano Medic® | Vapor | 58.4 ± 7.6 (13.0) | 58.5 ± 6.7 (11.4) | 51.4 ± 5.2 (10.2) | 64.0 ± 6.7 (10.5) | 73.3 ± 2.6 (3.6) |
| Residue | 15.0 ± 0.9 (6.0) | 9.9 ± 3.3 (33.3) | 11.3 ± 3.8 (33.2) | 2.7 ± 2.1 (76.2) | 2.4 ± 2.3 (94.2) | |
| Device parts | 1.6 ± 0.2 (15.1) | 3.6 ± 1.1 (29.2) | 1.8 ± 1.0 (56.9) | 0.7 ± 0.4 (52.1) | 0.8 ± 0.4 (59.0) | |
| Connection tube | < LLOQ | < LLOQ | < LLOQ | < LLOQ | < LLOQ | |
| Sum | 74.9 ± 6.9 (9.2) | 72.0 ± 6.7 (9.3) | 64.6 ± 2.9 (4.5) | 67.4 ± 7.7 (11.4) | 76.5 ± 3.2 (4.2) | |
| Plenty Vaporizer® | Vapor | 66.8 ± 4.3 (6.5) | 61.9 ± 3.6 (5.7) | 56.1 ± 2.5 (4.5) | 50.7 ± 3.3 (6.5) | 59.8 ± 3.9 (6.4) |
| Residue | 2.1 ± 0.3 (12.7) | 2.0 ± 0.7 (34.1) | 1.1 ± 0.5 (43.0) | 0.4 ± 0.1 (14.5) | 0.4 ± 0.1 (21.0) | |
| Device parts | 23.9 ±3.0 (12.6) | 25.7 ± 1.6 (6.1) | 18.7 ± 3.6 (19.4) | 22.3 ± 2.6 (11.5) | 21.0 ± 2.3 (11.1) | |
| Connection tube | < LLOQ | < LLOQ | < LLOQ | < LLOQ | < LLOQ | |
| Sum | 92.8 ± 4.0 (4.3) | 89.6 ± 4.5 (5.0) | 75.8 ± 3.8 (5.0) | 73.0 ± 4.4 (6.0) | 81.2 ± 3.3 (4.1) | |
| Arizer Solo® | Vapor | 82.7 ± 6.0 (7.3) | 75.8 ± 5.9 (7.8) | 70.0 ± 8.1 (11.6) | 67.5 ± 4.4 (6.5) | 73.8 ± 4.8 (6.5) |
| Residue | 1.8 ± 0.7 (41.8) | 3.0 ± 1.6 (53.2) | 1.6 ± 1.5 (94.2) | < LLOQ | < LLOQ | |
| Device parts | 13.6 ± 2.5 (18.5) | 10.1 ± 2.0 (19.5) | 9.8 ± 1.9 (19.2) | 11.3 ± 3.2 (28.4) | 11.5 ± 3.6 (31.5) | |
| Connection tube | < LLOQ | < LLOQ | < LLOQ | < LLOQ | < LLOQ | |
| Sum | 98.1 ± 7.1 (7.3) | 88.9 ±5.0 (5.6) | 81.3 ± 5.1 (6.3) | 79.0 ± 2.6 (3.2) | 85.4 ± 1.6 (1.9) | |
| DaVinci Vaporizer® | Vapor | 54.6 ± 6.0 (11.0) | 48.5 ± 1.8 (3.6) | 56.7 ± 3.2 (5.7) | 37.3 ± 8.1 (21.7) | 47.2 ± 5.9 (12.5) |
| Residue | 4.7 ± 2.2 (47.2) | 3.6 ± 0.4 (11.9) | 3.3 ± 0.5 (14.5) | 3.2 ± 2.3 (71.3) | 3.1 ± 2.3 (72.3) | |
| Device parts | 7.4 ± 0.9 (11.6) | 12.9 ± 3.2 (24.5) | 8.1 ± 1.6 (20.1) | 15.5 ± 3.5 (22.8) | 20.3 ± 3.4 (17.0) | |
| Connection tube | 0.8 ± 0.2 (26.1) | < LLOQ | 1.3 ± 0.3 (25.2) | 0.6 ± 0.1 (16.4) | 0.8 ± 0.1 (15.5) | |
| Sum | 67.5 ± 6.5 (9.6) | 63.3 ± 4.5 (7.1) | 68.6 ± 4.6 (6.7) | 56.7 ± 11.5 (20.3) | 71.5 ± 8.9 (12.4) | |
| Vape-or-Smoke™ | Vapor | 55.9 ± 5.4 (9.7) | 48.2 ± 15.2 (31.5) | 45.9 ± 17.1 (37.2) | 27.1 ± 5.9 (21.7) | 27.9 ± 5.7 (20.5) |
| Residue | 16.2 ± 2.9 (17.8) | 14.4 ± 20.7 (143.4) | 14.7 ± 22.5 (152.7) | 46.8 ± 7.4 (15.7) | 44.1 ± 8.9 (20.2) | |
| Device parts | 12.4 ± 2.7 (21.7) | 9.0 ± 1.7 (19.0) | 9.2 ± 1.9 (20.7) | 8.3 ± 2.1 (25.3) | 8.7 ± 1.8 (21.0) | |
| Connection tube | 0.8 ± 0.1 (8.5) | < LLOQ | 0.5 ± 0.2 (45.4) | 0.7 ± 0.1 (8.4) | 0.7 ± 0.1 (15.9) | |
| Sum | 85.4 ± 0.3 (0.3) | 71.6 ± 7.1 (9.9) | 70.3 ± 6.5 (9.2) | 82.8 ± 2.4 (2.9) | ± 2.1 (2.6) | |
1 Mean and SD in μg/mL, RSD in %.
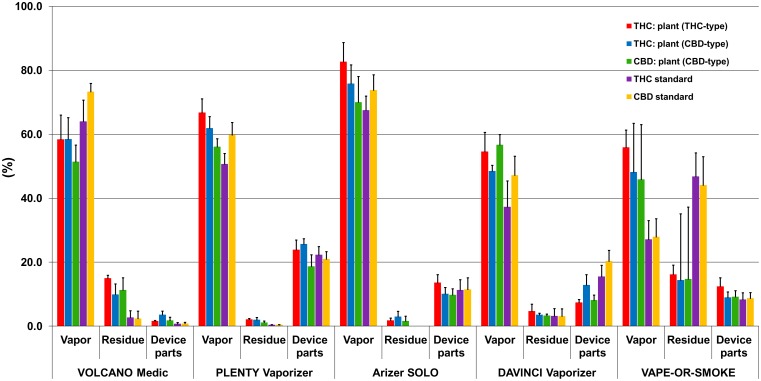
Rysunek 3
Procentowa zawartość kanabinoidów w oparach, pozostałościach i częściach urządzeń Volcano Medic®, Plenty Vaporizer®, Arizer Solo®, DaVinci Vaporizer® i Vape-or-Smoke™.
Przedstawione są wartości średnie + 1 SD. Pręty, od lewej do prawej: THC z konopi indyjskich typu THC; THC z konopi indyjskich typu CBD; CBD z konopi indyjskich typu CBD; standard THC; standard CBD.
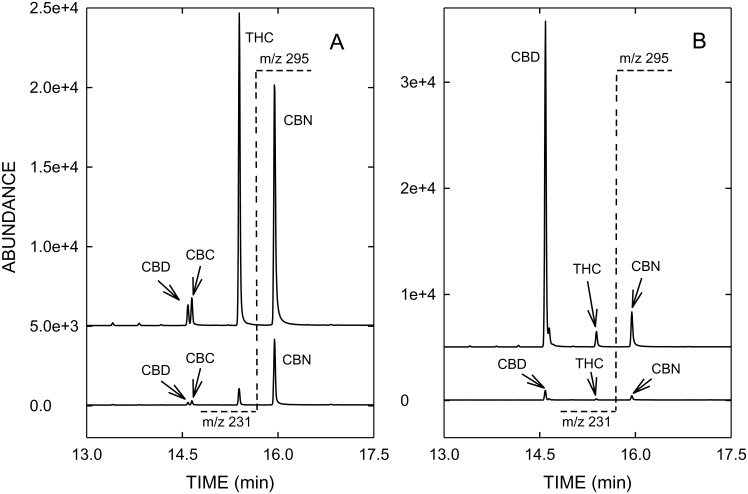
Rysunek 4
Profile GC/MS-SIM pary (górne wykresy) i pozostałości (dolne wykresy) po waporyzacji marihuany typu THC (A) i CBD (B) za pomocą urządzenia DaVinci Vaporizer®.
Jon docelowy m/z 231 CBD i THC jest przedstawiony po lewej stronie linii kropkowanej w czasie 15,6 min, natomiast m/z 295 jako jon docelowy CBN jest przedstawiony po prawej stronie linii kropkowanej. Skróty jak na rys. 1.
Stosując konopie indyjskie (oba rodzaje) i Volcano Medic® stwierdzono ponad 58% THCtot w oparach, podczas gdy odzysk CBDtot był nieco niższy o 51,4%. Z drugiej strony, odzysk THC i CBD był wyższy odpowiednio o 64,0 i 73,3% w porównaniu z konopiami indyjskimi podczas waporyzowania wzorców kanabinoidowych, podczas gdy ilość kanabinoidów pozostałych w pozostałościach była znacznie niższa.
Powodem może być fakt, że wzorce kanabinoidowe znajdowały się w komorze na próbki bezpośrednio na metalowej podkładce przeznaczonej do przechowywania płynów, co ułatwiało waporyzację wzorców. Wartości RSD THCtot i CBDtot w próbkach oparów wynosiły odpowiednio od 10 do 13% i od 3,6 do 10%. Przy parowaniu wzorców kanabinoidowych odzysk CBD był wyższy niż THC.
THC i CBD pozostawione w pozostałościach po waporyzacji wynosiły odpowiednio ≤ 15% i < 3% dla wzorców marihuany i kanabinoidów. Zmienność kannabinoidów pozostawionych w pozostałościach zależała od odsetka kannabinoidów ogółem stwierdzonych w tych próbkach.
Wartości RSD były najwyższe i wynosiły do 94,2% dla wzorców kannabinoidowych, przy czym w pozostałościach pozostawała najniższa zawartość. Jedynie niewielki odsetek ≤ 3,6% całkowitych kannabinoidów został osadzony na częściach urządzenia (tj. komorze próbki, zaworze łączącym i ustniku). Kannabinoidy adsorbowane na baloniku nie zostały zmierzone, co może być jednym z wyjaśnień, dlaczego suma wszystkich frakcji mieściła się w przedziale od 64,6 do 76,5% przy RSD wynoszącym < 11,4%.
Przy 50,7 do 66,8% odzysku w oparach preparatu Plenty Vaporizer® był podobny do tego, jaki miał Volcano Medic®. W przypadku tego urządzenia inhalacyjnego nie zaobserwowano żadnych różnic pomiędzy standardami dla konopi indyjskich i kanabinoidów.
Wartości RSD były istotnie niższe niż w przypadku Volcano Medic®, co wskazuje na wiarygodne i ilościowe uwalnianie kannabinoidów z matrycy próbki. W przypadku 1,1 do 2,1% (konopie indyjskie) i 0,4% (kannabinoidy) w pozostałościach po waporyzacji z zastosowaniem Plenty Vaporizer® pozostało znacznie mniej kannabinoidów w porównaniu z Volcano Medic®.
W częściach urządzenia stwierdzono jednak znaczny udział kanabinoidów ogółem, wynoszący od 18,7 do 25,7%. Niektóre kondensacji pary (RSD 6,1-19,4%), w wyniku czego osadzanie się i utrata kanabinoidów występuje w długiej metalowej rury chłodzącej z lamelkami przeznaczonymi do chłodzenia pary przed wdychaniem. Suma kannabinoidów znalezionych we wszystkich frakcjach był z 89,6%- 92,8% najwyższy dla THC waporyzowanego z konopi indyjskich.
Największy odzysk uzyskano przy użyciu Arizer Solo®, a mianowicie 67,5-82,7%. Nie zaobserwowano różnic pomiędzy THC i CBD. Z wyjątkiem CBD waporyzowanego z konopi (RSD = 11,6%), zmienność ta była niewielka, a wartości RSD wynosiły zazwyczaj < 8%. Jedynie niewielka część ≤ 3% kannabinoidów pozostała w pozostałościach po waporyzacji konopi indyjskich i nie stwierdzono kannabinoidów w kawałku bawełny użytym do waporyzacji wzorców kannabinoidowych.
Dodatkowe 9,8%- 13,6% THCtot i CBDtot zostało zaadsorbowane na szklanej probówce i komorze próbki urządzenia, co dało całkowity odzysk na poziomie 79,0-98,1%. Suma kanabinoidów znalezionych w różnych frakcjach była najwyższa dla THC waporyzowanego z konopi indyjskich i osiągnęła 88,9% w przypadku CBD i 98,1% w przypadku konopi indyjskich typu THC. Stosunkowo prosta konstrukcja urządzenia, składająca się z gładkich powierzchni i obojętnych materiałów, takich jak metal i szkło, może być odpowiedzialna za wysoką wydajność.
Odsetek konopi indyjskich znalezionych w oparach urządzenia DaVinci Vaporizer® wahał się od 48,5 do 56,7% i od 37,3 do 47,2% odpowiednio w przypadku konopi indyjskich i kanabinoidu. Olej dostarczony z urządzeniem DaVinci Vaporizer® został użyty do waporyzacji kanabinoidowych wzorców rozpuszczonych w MeOH.
Wprowadzenie puszki z olejem do komory próbek zmienia konstrukcję urządzenia, ponieważ olej musi być ogrzewany pasywnie przez komorę próbek. Może to być przyczyną niższego odzysku uzyskanego za pomocą wzorców kanabinoidowych. Zmienność ta była mniejsza w przypadku konopi indyjskich (RSD ≤ 11%) i większa w przypadku wzorców (< 22%).
Mniej niż 5% THCtot i CBDtot pozostało w pozostałościach po waporyzacji marihuany lub wzorców. W przypadku konopi indyjskich, do 12,9% THC i CBD zostało zaadsorbowane na częściach urządzenia. Z 15,5-20,3% większy udział THC i CBD pozostał na częściach urządzenia po waporyzacji kanabinoidu lub wzorca. Jest to kolejna wskazówka, że wprowadzenie puszki z olejem do komory próbki powoduje zmianę rozkładu ciepła i/lub temperatury, utrudniając tym samym proces waporyzacji.
Przy ≤ 1,3%, w rurce łączącej znaleziono jedynie niewielkie ilości kanabinoidów. Całkowity odzysk jako suma wszystkich frakcji był niższy niż w przypadku pozostałych waporyzatorów i wynosił od 56,7% do 71,5%. Może to wynikać z ograniczonego uszczelnienia komory próbki.
Najważniejszą różnicą pomiędzy testowanymi waporyzatorami Vape-or-Smoke™ i wszystkimi innymi jest to, że Vape-or-Smoke™ nie jest ogrzewana elektrycznie, lecz za pomocą płomienia gazu butanowego. W związku z tym nie można regulować i kontrolować temperatury. Dlatego też trudno jest utrzymać stabilne warunki doświadczalne, co widać w dużej zmienności wszystkich pomiarów.
Od 45,9% do 55,9% wszystkich kannabinoidów obecnych w konopiach indyjskich zostało odzyskanych z pary o wartościach RSD pomiędzy 9,7% a 37,2%. Zaledwie 27-28% wzorców konopi indyjskich zostało znalezionych w parze, co najprawdopodobniej wynika z ustawień doświadczalnych. W przypadku Arizer Solo®, wzorce zostały waporyzowane z kawałka bawełny wprowadzonego do komory próbki. Dolna część bawełny zmieniła kolor na brązowy podczas waporyzacji i wyizolowała prawdopodobnie górną część granulatu, co spowodowało niepełne waporyzowanie kannabinoidów.
Z tego powodu w pozostałościach pozostało od 44,1 do 46,8% wzorców kannabinoidowych. W przypadku konopi indyjskich w pozostałościach stwierdzono od 14,4 do 16,2% ogółu kannabinoidów. Również w tym przypadku zmienność ta była bardzo duża, a wartości RSD do 152,7%, co świadczy o trudnościach w utrzymaniu stabilnych warunków parowania. Ogółem we wszystkich frakcjach łącznie stwierdzono od 70,3 do 85,4% wszystkich kannabinoidów i nie stwierdzono żadnych różnic pomiędzy badanymi materiałami.
W wyniku wysokiej temperatury parowania stężenie CBN w parze, powstałej w wyniku utleniania THC, jest nieznacznie zwiększone w porównaniu z konopiami (patrz rys. 11 i 4A).4A). Podczas waporyzacji konopi indyjskich ważnym zagadnieniem jest efektywna i ilościowa dekarboksylacja kwaśnych kannabinoidów, zwykle dominujących w świeżych konopiach, ponieważ neutralne THC i CBD są uważane za farmakologicznie aktywne. W przeciwieństwie do GC/MS, gdzie do zapobiegania termicznej dekarboksylacji kwaśnych kannabinoidów wymagana jest derywatyzacja (np. sililowanie), HPLC umożliwia bezpośrednią analizę kwaśnych i obojętnych kannabinoidów.
Całkowite szybkości dekarboksylacji osiągnięte za pomocą różnych waporyztaorów zostały podsumowane w tabeli 2. Doskonałą i niezawodną dekarboksylację THCA-A i CBDA zaobserwowano w przypadku wszystkich waporyzatorów do suszu CBD o napędzie elektrycznym, co pozwoliło na dokładną kontrolę temperatury.
Przy użyciu ≥ 99,8% waporyzatora Plenty Vaporizer® i DaVinci Vaporizer® wykazały najwyższą skuteczność dekarboksylacji. Przy współczynniku dekarboksylacji 97,3 do 98,7%, podobne współczynniki dekarboksylacji stwierdzono odpowiednio w przypadku Volcano Medic® i Arizer Solo®.
Jedynie w przypadku CBD stwierdzono nieco niższą skuteczność dekarboksylacji po waporyzacji za pomocą Volcano Medic®. Z drugiej strony, w przypadku Vape-or-Smoke™ operowanego płomieniem gazu butanowego wykazano niższą dekarboksylację kwaśnych kanabinoidów z odpowiednimi szybkościami od 87,7 do 93,3%.
Ponadto stwierdzono, że zmienność dekarboksylacji była na ogół większa w przypadku tego urządzenia z wartościami RSD do 12,7%, co odzwierciedlało trudności w utrzymaniu stałej temperatury. Rysunek 5 z odpowiednimi profilami HPLC pokazuje, że w przypadku konopi indyjskich THC THCA-A jest prawie całkowicie przekształcany w THC (A). To samo dotyczy konopi indyjskich typu CBD (B), tj. dekarboksylacji CBDA na CBD.
Table 2
| Waporyzator | THC-type Cannabis [Mean ± SD (RSD %)] | CBD-type Cannabis [Mean ± SD (RSD %)] | |
|---|---|---|---|
| THC (%) | THC (%) | CBD (%) | |
| Volcano Medic® | 97.3 ± 1.1 (1.2) | 97.3 ± 1.3 (1.3) | 94.6 ± 2.2 (2.3) |
| Plenty Vaporizer® | 99.8 ± 0.1 (0.1) | 99.8 ± 0.1 (0.1) | 99.8 ± 0.1 (0.1) |
| Arizer Solo® | 98.6 ± 0.9 (0.9) | 97.8 ± 1.7 (1.7) | 98.7 ± 1.1 (1.1) |
| DaVinci Vaporizer® | 99.9 ± 0.0 (0.0) | 99.8 ± 0.1 (0.1) | 99.8 ± 0.1 (0.1) |
| Vape-or-Smoke™ | 87.7 ± 2.3 (2.6) | 93.3 ± 7.9 (8.5) | 91.3 ± 11.6 (12.7) |
Rysunek 5
Profile HPLC próbek oparów zebranych z konopi indyjskich typu THC (A) i CBD (B) po waporyzacji za pomocą urządzenia DaVinci Vaporizer®.
Skróty jak na rysunku 2.
Wnioski
Coraz większym zainteresowaniem cieszy się używanie konopi indyjskich do celów medycznych w leczeniu lub łagodzeniu różnych objawów różnych chorób. Ponieważ doustne podawanie konopi indyjskich ujawnia słabą i niewiarygodną biodostępność, a palenie konopi indyjskich nie może być zalecane do celów medycznych, potrzebne są alternatywne, skuteczne i mniej szkodliwe sposoby stosowania.
Taką alternatywą wydaje się być waporyzacja konopi indyjskich bez tworzenia potencjalnie toksycznych produktów pirolizy. W tym badaniu przeprowadziliśmy walidację in vitro 4 elektrycznych i 1 gazowej aparatury do waporyzowania konopi w zakresie ich zdolności do uwalniania THC i CBD z parą.
Napędzane elektrycznie urządzenia, umożliwiające precyzyjną kontrolę temperatury, wykazały prawie całkowitą dekarboksylację kwaśnych kannabinoidów THCA-A i CBDA oraz dobre lub doskonałe odzyskiwanie neutralnych kannabinoidów THC i CBD w parze. Wskazania do spalania konopi, np. popiół pozostawiony w komorze próbki i widoczny dym, stwierdzono tylko w przypadku zasilanego gazem Vape-or-Smoke™.
Ponadto, w przypadku tego waporyzatora zaobserwowano niepewną dekarboksylację i waporyzowanie kanabinoidów w wyniku braku kontroli temperatury. Dlatego też urządzenia zasilane gazem nie mogą być zalecane do celów terapeutycznych.
Względne ilości neutralnych kannabinoidów uwalnianych do pary różniły się znacznie pomiędzy 4 urządzeniami zasilanymi elektrycznie. Największą różnicę zaobserwowano w przypadku THC waporyzowanego z konopi indyjskich typu THC – odpowiednio 54,6% i 82,7% w przypadku urządzeń DaVinci Vaporizer® i Arizer Solo®. Tutaj wydajność różniła się o 50% pomiędzy urządzeniem o najniższej i najwyższej wydajności parowania.
Najniższe wartości odzysku pomiędzy 48,5-58,5% dla konopi indyjskich uzyskano przy użyciu urządzenia DaVinci Vaporizer® i Volcano Medic®, podczas gdy urządzenie Plenty Vaporizer® uwalniało do pary 56,1-66,8% wszystkich konopi indyjskich.
Najlepszy odzysk uzyskano w przypadku Arizer Solo® z 70,0-82,7%. Im lepszy odzysk, tym mniej leków (konopi indyjskich lub kanabinoidów) jest potrzebnych do dostarczenia pacjentowi określonej dawki terapeutycznej. Jest to kwestia ekonomiczna, jeśli chodzi o efektywność kosztową terapii z zastosowaniem leczniczych konopi indyjskich. Innym aspektem jest niezawodne i stałe uwalnianie kannabinoidów do pary, aby zagwarantować jednolitość dawkowania, co odzwierciedlają wartości RSD uzyskane dla różnych urządzeń.
Wszystkie wyparki z napędem elektrycznym wykazywały niewielkie wahania przy wartościach RSD ≤ 13%. Doskonałą powtarzalność stwierdzono dla waporyzatora Plenty Vaporizer® (RSD ≤ 6,5%). Należy również zauważyć, że konstrukcja waporyzatorów miała wpływ na wydajność kannabinoidów uwalnianych wraz z parą.
Urządzenia takie jak Volcano Medic® i Plenty Vaporizer® zapewniające raczej zimną parę przy łagodnym, mniej drażniącym dla dróg oddechowych wdychaniu wykazały mniejszy odzysk kanabinoidów w parze w porównaniu z Arizer Solo®.
Jednak urządzenie to, zaprojektowane tak, aby uwalniać maksymalną ilość kannabinoidów do pary i pozbawione rurki chłodzącej, wytwarza dość gorącą parę, która może być mniej tolerowana przez pacjentów.
Podsumowując, 4 elektrycznie napędzane i sterowane temperaturą katalizatory badane w tym badaniu skutecznie dekarboksylują kwaśne kannabinoidy i niezawodnie uwalniają odpowiadające im neutralne kannabinoidy do pary. W związku z tym można je uznać za obiecujący sposób bezpiecznego i skutecznego podawania leczniczych konopi indyjskich i kannabinoidów.
Po obecnej walidacji in vitro wymagane są jednak badania kliniczne w celu potwierdzenia skuteczności waporyzatorów jako narzędzi do stosowania terapeutycznego.
Informacje pomocnicze S1 Tabela Walidacja testu GC/MS. (DOCX) Kliknij tutaj, aby uzyskać dodatkowy plik danych.(24K, docx) S2 Tabela Walidacja testu HPLC. (DOCX) Kliknij tutaj, aby uzyskać dodatkowy plik danych.(24K, docx) S3 Tabela Ilość zawartości konopi indyjskich w marihuanie typu THC i CBD z HPLC i GC/MS. (DOCX) Kliknij tutaj, aby uzyskać dodatkowy plik danych.(27K, docx) Idź do: Podziękowania Dziękujemy firmie Storz & Bickel GmbH (Tuttlingen, Niemcy) za dostarczenie Volcano Medic® i Plenty Vaporizer®. Przejdź do: Oświadczenie o finansowaniu Autorzy nie otrzymali żadnych konkretnych funduszy na tę pracę. Idź do: Dostępność danych Wszystkie istotne dane znajdują się w dokumencie i jego plikach z informacjami pomocniczymi. Przejdź do: Referencje: 1. Li H-L. Archeologiczna i historyczna relacja o marihuanie w Chinach. Econ Bot 1973; 28: 437-448. [Google Scholar] 2. O'Shaughnessy WB. O preparatach konopi indyjskich (Cannabis indica); ich wpływie na układ zwierząt w zdrowiu oraz użyteczności w leczeniu tężeca i innych chorób zakaźnych. Trans Med Phys Soc Bengal 1838. –1840: 421–461. [PMC free article] [PubMed] [Google Scholar] 3. Mechoulam R, Shvo Y. Hashish. I. Struktura Cannabidiol. Czworościan 1963; 19: 2073-2078. [PubMed] [Google Scholar] 4. Gaoni Y, Mechoulam R. Izolacja, struktura i częściowa synteza aktywnego składnika haszyszu. J Am Chem Soc 1964; 86: 1646-1647. [Google Scholar] 5. Radwan MM, Elsohly MA, Slade D, Ahmed SA, Wilson L, El-Alfy AT i in. Składniki inne niżannabinoidalne z odmiany Cannabis sativa o wysokiej mocy. Phytochemistry 2008; 69: 2627-2633. 10.1016/j.phytochem.2008.07.010 [PMC free article] [PubMed] [CrossRef] [Google Scholar]. 6. Radwan MM, Elsohly MA, Slade D, Ahmed SA, Khan IA, Ross SA. Biologicznie czynne kannabinoidy z Cannabis sativa o wysokiej mocy. J Nat Prod 2009; 72: 906-911. 10.1021/np900067k [PMC free article] [PubMed] [CrossRef] [Google Scholar]. 7. Hanus LO. Pharmacological and therapeutic secrets of plant and brain (endo)cannabinoids. Med Res Rev 2009; 29: 213-271. 10.1002/med.20135 [PubMed] [CrossRef] [Google Scholar]. 8. Devane WA, Dysarz FA 3., Johnson MR, Melvin LS, Howlett AC. Determinacja i charakterystyka receptora kannabinoidowego w mózgu szczura. Mol Pharmacol 1988; 34: 605-613. [PubMed] [Google Scholar] 9. Matsuda LA, Lolait SJ, Brownstein MJ, Young AC, Bonner TI. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Natura 1990; 346: 561–564. [PubMed] [Google Scholar] 10. Munro S, Thomas KL, Abu-Shaar M. Molekularna charakterystyka obwodowego receptora dla kannabinoidów. Natura 1993; 365: 61–65. [PubMed] [Google Scholar] 11. Atakan Z. 2012. Konopie indyjskie, roślina złożona: różne związki i różne oddziaływanie na osobniki. Ther Adv Psychopharmacol 2: 241-254. 10.1177/2045125312457586 [PMC free article] [PubMed] [CrossRef] [Google Scholar]. 12. Grotenhermen F, Muller-Vahl K. Potencjał terapeutyczny konopi i kannabinoidów. Dtsch Arztebl Int 2012; 109: 495-501. [PMC free article] [PubMed] [Google Scholar] 13. Ben Amar M. Cannabinoids w medycynie: Przegląd ich potencjału terapeutycznego. J Ethnopharmacol 2006; 105: 1-25. [PubMed] [Google Scholar] 14. Dewey WL. Farmakologia kannabinoidalna. Pharmacol Rev 1986; 38: 151-178. [PubMed] [Google Scholar] 15. Baker D, Pryce G, Giovannoni G, Thompson AJ. Potencjał terapeutyczny marihuany. Lancet Neurol 2003; 2: 291-298. [PubMed] [Google Scholar] 16. Russo EB. Oswajanie THC: potencjalna synergia marihuany i efekt fitokannabinoid-terpenoidalny entourage. Br J Pharmacol 2011; 163: 1344–1364. 10.1111/j.1476-5381.2011.01238.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]. 17. Pryce G, Riddall DR, Selwood DL, Giovannoni G, Baker D. Neuroprotection in experimental autoimmune encephalomyelitis and progressive multiple sclerosis by cannabis based cannabinoids. J Neuroimmune Pharmacol 2015; 10: 281-292. 10.1007/s11481-014-9575-8 [PubMed] [CrossRef] [Google Scholar]. 18. Russo E, Guy GW. Opowieść o dwóch kannabinoidach: uzasadnienie terapeutyczne połączenia tetrahydrokanabinolu i kannabidiolu. Med Hypotheses 2006; 66: 234-246. [PubMed] [Google Scholar] 19. Mechoulam R, Peters M, Murillo-Rodriguez E, Hanus LO. Cannabidiol-Rodriguez E, Hanus LO. Chem Biodivers 2007; 4: 1678-1692. [PubMed] [Google Scholar] 20. Agurell S, Halldin M, Lindgren JE, Ohlsson A, Widman M, Gillespie H i in. Farmakokinetyka i metabolizm delta-1-tetrahydrokanabinolu i innych kannabinoidów z naciskiem na człowieka. Pharmacol Rev 1986; 38: 21-43. [PubMed] [Google Scholar] 21. Ashton CH. Pharmacology and effects of cannabis: a brief review. Br J Psychiatria 2001; 178: 101-106. [PubMed] [Google Scholar] 22. Hazekamp A, Ruhaak R, Zuurman L, van Gerven J, Verpoorte R. Evaluation of a vaporizing device (Volcano) for the pulmonary administration of tetrahydrocannabinol. J Pharm Sci 2006; 95: 1308-1317. [PubMed] [Google Scholar] 23. Gieringer D. Badania nad marihuaną: badania nad rurami wodnymi. MAPY 1996; 6: 59-66. [Google Scholar] 24. Gieringer D. Waporyzacja marihuany: obiecująca strategia redukcji szkód spowodowanych dymem. J Cannabis Ther 2001; 1: 153-170. [Google Scholar] 25. Waporyzator Gieringer D. Cannabis łączy skuteczne dostarczanie THC z efektywnym tłumieniem związków pirolitycznych. J. Cannabis Ther 2004; 4: 7-27. [Google Scholar] 26. Fischedick J, Van Der Kooy F, Verpoorte R. Cannabinoid receptor 1 aktywność wiązania i analiza ilościowa dymu i oparów Cannabis sativa L.. Chem Pharm Bull (Tokyo) 2010; 58: 201-207. [PubMed] [Google Scholar] 27. Pomahacova B, Van der Kooy F, Verpoorte R. Cannabis smoke condensate III: zawartość kannabinoidów w waporyzowanej Cannabis sativa. Inhal Toxicol 2009; 21: 1108-1112. 10.3109/08958370902748559 [PubMed] [CrossRef] [Google Scholar]. 28. Abrams DI, Vizoso HP, Shade SB, Jay C, Kelly ME, Benowitz NL. Vaporization as a smokeless cannabis delivery system: a pilot study. Clin Pharmacol Ther 2007; 82: 572-578. [PubMed] [Google Scholar] 29. Naef M, Russmann S, Petersen-Felix S, Brenneisen R. Development and pharmacokinetic characterization of pulmonal and intravenous delta-9- tetrahydrocannabinol (THC) in humans. J Pharm Sci 2004; 93: 1176-1184. [PubMed] [Google Scholar] 30. Zuurman L, Roy C, Schoemaker RC, Hazekamp A, den Hartigh J, Bender JC, et al. Effect of intrapulmonary tetrahydrocannabinol administration in humans. J Psychopharmacol 2008; 22: 707-716. 10.1177/0269881108089581 [PubMed] [CrossRef] [Google Scholar]. 31. Earleywine M, Barnwell SS. Zmniejszone objawy oddechowe u osób używających konopi indyjskich, które waporyzują. Harm Reduct J 2007; 4: 11 [PMC free article] [PubMed] [Google Scholar] 32. Van Dam NT, Earleywine M. Pulmonary function in cannabis users: support for a clinical trial of the vaporizer. Int J Drug Policy 2010; 21: 511-513. 10.1016/j.drugpo.2010.04.001 [PubMed] [CrossRef] [Google Scholar]. 33. Food and Drug Administration. Wskazówki dotyczące walidacji przemysłowych metod bioanalitycznych. U.S. Department of Health and Human Services, Rockville, MD, 2001. Dostępny pod adresem http://www.fda.gov/downloads/Drugs/Guidances/ucm070107.pdf. [Google Scholar] 34. Dussy FE, Hamberg C, Luginbuhl M, Schwerzmann T, Briellmann TA. Isolation of delta-9-THCA-A from hemp and analytical aspects concerning the determination of delta-9-THC in cannabis products. Forensic Sci Int 2005; 149: 3-10. [PubMed] [Google Scholar]